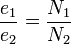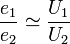Starea de agragare in care se gaseste o substanta este dependenta de presiune, de volum si de temperatura. Aceste marimi se numesc variabile de stare, intrucat folosesc la descrierea starii unei substante sau a unui amestec.
La o anumita cantitate de substanta, variabilele de stare sunt dependente intre ele. De exemplu, cand se incalzeste un corp, el se dilata, adica volumul este o functie de temperatura; daca se mareste volumul unui gaz la temperatura constanta, inseamna ca presiunea se micsoreaza, deci este dependenta de volum. Relatia matematica a variabile-
lor de stare reprezinta ecuatia termica de stare a substantei respective. Astfel, daca se noteaza presiunea cu p, volumul cu V si temperatura absoluta cu T, atunci intre aceste marimi exista relatia functionala:
f(p, V, T)=0
de unde, de exemplu, presiunea se poate exprima ca functie de volum si temperatura, adica p=f(V,T).
La gaze, fortele de atractie reciproca intre particule sunt slabe. Din acest punct de vedere se face o deosebire intre gaze perfecte sau ideale si gaze reale.
Gaze perfecte(ideale)
Prin gaze pefecte(ideale) se inteleg gazele la care fortele de atractie reciproca intre particule pot fi considerate nule.
Pentru a cerceta ecuatia termica de stare a gazelor perfecte se va considera constanta cate una din variabilele de stare si se va studia dependenta intre celelalte doua. Legile deduse astfel vor fi cuprinse apoi intr-o lege generala.
Legea lui Boyle-Mariotte
Legea lui Boyle- Mariotte arata ca : la temperatura constanta, volumul unei mase determinate de gaz este invers proportional cu presiunea sub care se afla gazul.
De exemplu, daca se dubleaza presiunea exercitata asupra a 2l gaz, volumul gazului descreste pana la 1 l. Matematic legea se scrie:
V1/ V2 = p2/ p1 ,
sau
p1 V1= p2 V2 ,
in care V1 si p1 reprezinta volumul si presiunea initiala a gazului, iar V2 si p2, noul volum si noua presiune.
Deci, la temperatura constanta, produsul dintre presiunea si volumul unei mase anumite de gaz este constant:
pV=k; k=const.
k este o constanta valabila pentru o anumita temperatura( si anumita cantitate de gaz). Reprezentand grafic dependenta presiunii p de volumul V se obtine pentru fiecare tempe-ratura o hiperbola echilaterala. Asemenea curbe se numesc izoterme(in lb. greaca: isos= egal, thermos= cald).
Legea lui Boyle-Mariotte are valabilitate in domeniul presiunilor nu prea mari si la temperaturi normale. La presiuni foarte inalte, toate gazele prezinta abateri de la aceas-
ta lege.Astfel, de exemplu, daca la azot la presiunea de 1 At, produsul pV=1, la 1000 At, pV>2, ceea ce dovedeste o abatere de la comportarea de gaz perfect.
Legea lui Gay-Lussac
Variatia volumului unui gaz cu temperatura la presiune constanta este exprima-ta prin legea lui Gay-Lussac: la presiune constanta, volumul unei mase determinate de gaz se mareste(sau se micsoreaza), pentru fiecare crestere(sau scadere) de 1 C, cu 1/273 din volumul pe care il ocupa la 0 C).
Valoarea 1/273, mai exact 1/273,15, se numeste coeficientul de dilatare termica a gazelor ideale.
Notand cu V0 volumul gazului la 0 C, iar cu V1 volumul pe care il ocupa la temperatura t1, legea se poate scrie:
V1= V0+V0/273t1=V0(273+t1/273).
Adoptand notarea temperaturilor in grade Kelvin: T=273+t, legea lui Gay-Lussac poate fi exprimata intr-o forma mai adecvata:
V1= V0*T1/273.
Deoarece V0/273 are o valoare constanta pentru gazul respectiv, inseamna ca la o temperatura T2, volumul aceluiasi gaz va fi:
V1= V0 *T2/273.
Asadar:
V1/V2=T1/T2 sau V1/T1= V2/T2.
Deci, la presiune constanta, volumul unei mase determinate de gaz variaza direct proportional cu temperatura absoluta:
V/T=k’; k’=const;
Reprezentarea grafica a relatiei intre volumul gazului si temperatura la presiu-ne constanta este o dreapta care intersecteaza ordonata intr-un punct ce corespunde valo-rii V0. O asemenea dreapta se numeste izobara(in lb. greaca barys=greu).
Pentru mase diferite de gaze rezulta o familie de drepte care intersecteaza ordonata in puncte diferite si se intalnesc intr-un punct pe abscisa, corespunzator la
t=-273 C
In mod analog, legea lui Gay-Lussac arata ca: la volum constant, presiunea unui gaz creste(sau scade) pentru fiecare crestere(sau scadere) de 1 C, cu 1/273 din presiunea pe care o are gazul la 0 C.
Asa, de exemplu, un gaz cu volumul de 273 ml la 0 C are volumul 273 ml la
1 C(si aceeasi presiune), de 275 ml la 2 C, de 373 ml la 100 C etc.
Daca se noteaza cu p0 presiunea gazului la 0 C, iar cu p1 presiunea gazului la temperatura t1, aceasta lege se poate scrie:
p1=p0+p0/273* t1=p0((273+t1)/273).
Rationand in modul aratat mai sus, se ajunge la relatia:
p1/ p2= T1/ T2 sau p1/ T1= p2/T2.
Deci, la volum constant, presiunea unei mase determinate de gaz variaza direct proportional cu temperatura absoluta:
P/T=k’’; k’’=const.
Reprezentarea grafica a relatiei dintre presiunea gazului si temperatura la volum constant este o dreapta care intersecteaza ordonata intr-un punct ce corespunde valorii p0. O asemenea dreapta se numeste izocora(in lb. greaca: core=spatiu).
Pentru mase diferite de gaze p0 are valori diferite, iar izocorele sunt drepte care se intalnesc intr-un punct pe abscisa, corespunzand la t=-273 C.
Legea lui Avogadro
Cand se combina un volum de hidrogen cu un volum de clor rezulta doua volume de acid clorhidric; tot asa, cand se combina doua volume de hidrogen cu un volum de oxigen se obtin doua volume doua volume de apa(vapori); prin combinarea a trei volume de hidrogen cu un volum de azot se obtin doua volume de amoniac gazos. Se constata ca volumele gazelor care se combina se gasesc intre ele in raporturi de numere intregi si mici 1:1; 2:1; 3:1.
Tot asa si intre volumul compusilor rezultati si volumul fiecareia dintre compo-
nente exista de asemenea un raport simplu 2:1; 2:2; 2:3, respectiv 2:1; 2:1; 2:1.
Studiind raporturile de combinare a volumelor in timpul reactiilor chimice, intre gaze, Gay-Lussac a stabilit(1808) ca: volumele a doua gaze care se combina se afla intre ele, cum si fata se volumul combinatiei rezultate din reactie, intr-un raport de numere intregi si mici(legea volumelor constante).
Comportarea gazelor la variatii de presiune si temperatura cum isi raportul de volume simple rezultate din reactiile lor chimice a condus pe A.Avogadro sa enunte(in 1811) ipoteza devenita ulterior lege: volume egale de gaze diferite, in aceleasi conditii de temperatura si presiune, contin acelasi numar de molecule. Aceasta lege arata ca, daca, de exemplu, la o anumita temperatura si presiune, un volum de hidrogen contine A molecule de hidrogen, un acelasi volum de clor, la aceeasi temperatura si presiune, contine tot A molecule de clor.
Cand se combina un volum de hidrogen cu un volum egal de clor, inseamna ca toate moleculele din volumul de hidrogen se combina cu toate moleculele din volumul de clor si rezulta 2 A molecule de acid clorhidric.
Dupa legea lui Avogadro, la numere egale de molecule, volumele substantelor gazoase corespunzatoare trebuie sa fie egale, si deoarece la A molecule corespunde un volum, la 2A molecule trebuie sa corespunda doua volume. Asa se explica de ce acidul clorhidric ocupa doua volume.
Cand se combina doua volume de hidrogen cu un volum de oxigen reactia decurge intre 2Amolecule de hidrogen si A molecule de oxigen. Gazele avand moleculele formate din doi atomi, in reactie 4A atomi de hidrogen se combina cu 2A atomi de oxi-
gen. Deoarece o molecula de apa contine doi atomi de hidrogen si un atom de oxigen, din reactie rezulta 2A de molecule de apa.
In mod similar, cand se combina trei volume de hidrogen cu un volum de azot, se combina 3A molecule de hidrogen cu A molecule de azot. Aceasta inseamna ca reactia are loc intre 6A atomi de hidrogen si 2A atomi de azot. Deaoarece o molecula de amoniac este formata din trei atomi de hidrogen si un atom de azot, din reactie rezulta 2A molecule de amoniac, carora le corespund doua volume.
Prin urmare, cu ajutorul legii lui Avogadro, tinand seama de raportul de combinare, legea volumelor constante este verificata in intregime.
Determinarea numarului de atomi dintr-o molecula de gaz.
Din legea lui Avogadro rezulta o consecinta foarte importanta, si anume ca moleculele celor mai cunoscute gaze elementare, ca de exemplu hidrogenul, oxigenul, clorul sunt biatomice. Rationamentul este urmatorul: daca un volum de hidrogen reactio-
neaza cu un volum de clor pentru a forma doua volume de acid clorhidric, inseamna ca fiecare molecula a compusului trebuie sa contina cel putin un atom de hidrogen si un atom de clor. Fiindca doua volume de acid clorhidric sunt obtinute din un volum de hidrogen si un volum de clor concluzia este ca fiecare molecula de hidrogen sau de clor contine doi atomi.
Volum molar. Cu ajutorul legii lui Avogadro se poate determina volumul unei molecule-gram de gaz.. Daca volume egale de gaze diferite, luate in aceleasi conditii de temperatura si presiune, contin acelasi numar de molecule, ocupa volume egale.
Tinand seama ca o molecula-gram a unei substante(un mol) reprezinta cantitatea dintr-o substanta a carei masa, exprimata in grame, este numeric egala cu masa ei mole-culara, inseamna ca in molecula-gram a diferitelor substante exista acelasi numar de molecule. Astfel, un mol de orice de gaz contine 23
6,025*10 molecule. Acest numar se numeste numarul lui Avogadro si se noteaza cu N. El reprezinta totodata si numarul de atomi cuprinsi intr-un atom-gram.
Deoarece, dupa Avogadro, acelasi numar de molecule intr-un gram de gaz in conditii egale ocupa acelasi volum, inseamna ca o molecula-gram de gaz, care contine
23
6,025*10 molecule, ocupa acelasi volum, independent de natura gazului.
Volumul ocupat de o molecula-gram din orice gaz(la 0 C si 760 mm Hg) este de 22,414 l. El se numeste volum molar sau volum molecular.
Volumul molar a fost calculat din raportul dintre molecula-gram si densitatea gazelor.Cunoscand volumul molar al gazelor se pot rezolva problemele care se refera la relatia intre volumul si masa gazelor.
Ecuatia de stare a gazelor perfecte
Legea lui Boyle-Mariotte pV=k, si legea lui Gay-Lussac: V/T=k’, pot fi reunite intr-o singura expresie. Pentru aceasta se considera ca gazul respectiv are initial presiunea
p0=1 At, T0=273 K si volumul V0.(Aceste conditii se numesc normale).
Daca, mentinand presiunea constanta, gazul se incalzeste la temperatura T, volu-
mul va creste de la V0 la Vt :
Vt= V0/ T0*T. (1)
Daca mentinand acum temperatura constanta, se mareste presiunea gazului de la p0 la p, volumul va creste de la Vt la V:
p0 Vt=pV (2)
Introducand valoarea lui Vt din relatia (1), rezulta:
p0V0/T0=pV/T (3)
Deoarece in partea stanga a relatiei sunt numai marimi constante, inseamna ca si partea dreapta trebuie sa fie constanta, adica:
pV/T=k. (4)
Daca se aplica relatia (4) la un mol al unui gaz, care, conform legii lui Avogadro, are un volum constant V, rezulta ca :
pV/T=R (5)
Constanta R este independenta de natura gazului; ea se numeste constanta gazelor perfecte( sau mai simplu, constanta gazelor). Expresia:
pV=RT
se numeste ecuatia de stare a gazelor perfecte.
Daca n molecule-gram de gaz ocupa volumul V, atunci 1 mol va ocupa volumul
V/n . Ecuatia de stare a gazelor perfecte devine atunci:
p*V/n=RT,
sau
pV= nRT. (6)
Numarul n de molecule-gram este insa egal cu raportul dintre masa m a gazului, exprimata in grame, si valoarea mesei lui moleculare, M, adica:
n=m/M
Inlocuind aceasta relatie in formula de mai sus, se obtine expresia:
pV=m/M*RT.