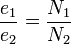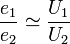sâmbătă, 4 iunie 2011
Retete culinare
Ravioli cu branza
Salata mixta
O salata delicioasa, care combina carnea usoara de pui - pieptul gustos - cu legumele (ardei gras, mazare) si orez fiert, totul condimentat cu mustar, otet de fructe si tarhon. Alunele care asezoneaza aceasta salata mixta si care pot fi inlocuite cu succes de nuci sau seminte de floarea-soarelui, ii confera o consistenta ceva mai crocanta si un gust deosebit. Nu mai pofti! Pune-te pe treaba si... pofta buna!
Ingrediente si cantitati:
400 g piept de pui fiert;
3 ardei grasi rosii;
150 g orez fiert;
150 g mazare fiarta;
2 linguri mustar;
4 linguri ulei;
2 linguri otet de fructe;
1 lingura patrunjel verde tocat;
1 lingura tarhon tocat;
2 linguri alune, prajite si zdrobite;
sare;
piper.
Mod de preparare:
1. Ardeii grasi se spala si se coc pe plita, dupa care se curata de pielite, seminte si se rup fasii subtiri.
2. Intr-un castron, se pun orezul fiert, mazarea fiarta, pieptul de pui, taiat fasii inguste, si fasiile de ardei copti. Se amesteca usor.
3. Mustarul se freaca bine cu uleiul, dupa care se adauga otetul de fructe, tarhonul tocat, sarea si piperul.
4. Sosul preparat se toarna in castronul cu mazare, orez, carne si ardei. Se amesteca pentru omogenizare. Salata se pune la rece, pentru minimum o ora, inainte de a fi servita.
5. Cand se aduce la masa, se presara cu patrunjel verde tocat si alune prajite si zdrobite.
Sugestie:
Alunele pot fi inlocuite cu nuci sau seminte de floarea-soarelui decojite, care se prajesc usor, intr-o tigaie, fara grasime, apoi se zdrobesc cu un sucitor de lemn.
Timp de preparare: 25 de minute, plus timpul de stat la rece.
Se obtin 4 portii.
Ingrediente si cantitati:
400 g piept de pui fiert;
3 ardei grasi rosii;
150 g orez fiert;
150 g mazare fiarta;
2 linguri mustar;
4 linguri ulei;
2 linguri otet de fructe;
1 lingura patrunjel verde tocat;
1 lingura tarhon tocat;
2 linguri alune, prajite si zdrobite;
sare;
piper.
Mod de preparare:
1. Ardeii grasi se spala si se coc pe plita, dupa care se curata de pielite, seminte si se rup fasii subtiri.
2. Intr-un castron, se pun orezul fiert, mazarea fiarta, pieptul de pui, taiat fasii inguste, si fasiile de ardei copti. Se amesteca usor.
3. Mustarul se freaca bine cu uleiul, dupa care se adauga otetul de fructe, tarhonul tocat, sarea si piperul.
4. Sosul preparat se toarna in castronul cu mazare, orez, carne si ardei. Se amesteca pentru omogenizare. Salata se pune la rece, pentru minimum o ora, inainte de a fi servita.
5. Cand se aduce la masa, se presara cu patrunjel verde tocat si alune prajite si zdrobite.
Sugestie:
Alunele pot fi inlocuite cu nuci sau seminte de floarea-soarelui decojite, care se prajesc usor, intr-o tigaie, fara grasime, apoi se zdrobesc cu un sucitor de lemn.
Timp de preparare: 25 de minute, plus timpul de stat la rece.
Se obtin 4 portii.
marți, 31 mai 2011
Transformatoare
Un transformator este o mașină electrică care transferă energie electrică dintr-un circuit (primarul transformatorului) în altul (secundarul transformatorului), funcționând pe baza legii inducției electromagnetice. Un curent electric alternativ care străbate înfășurarea primară produce un câmp magnetic variabil în miezul magnetic al transformatorului, acesta la rândul lui producând o tensiune electrică alternativă în înfășurarea secundară.
Funcția transformatorului
În circuitele și rețelele electrice, transformatorul realizează transfer de energie (electrică) dintr-un circuit (rețea) de anumiți parametri - tensiune U, curent I, rezistență R - , în energie electrică cu alți parametri (valori) de circuit, în condițiile unei separări (izolări) galvanice între cele două circuite (rețele) electrice. Practic se acceptă, că energia electrică obținută la ieșire, în circuitul (circuitele, dacă sunt mai multe) secundar este aproximativ egală cu cea de la intrare, din circuitul primar. Totuși în calcule de proiectare pierderile de energie (din transformator) sunt luate în considerație.
Principiul de funcționare
Presupunem că ambele circuite ale transformatorului au spirele înfășurate în același sens și că au N1 respectiv N2 spire[1]. Transformatorul se consideră că funcționează în gol (i2=0, adică circuitul secundar este deschis). Dacă se aplică transformatorului tensiunea alternativă u1 de valoare efectivă U1 în primar apare curentul de intensitate i1 și valoare efectivă I1. Acesta, conform legii Biot-Savart, dă naștere unui flux magnetic alternativ având valoarea instantanee Φ = Φmcos ωt. Acest flux variabil care străbate spirele ambelor înfășurări face să apară în cele N1 spire ale primarului o t.e.m. de autoinducție:
Dacă la bornele transformatorului se conectează un consumator rezistiv de rezistență RS, prin circuitul secundar va apărea curentul de intensitate i2. În acest caz, u2 ≈ e2 deoarece apare căderea de tensiune pe sarcină RS i2. În condiții normale (nominale) de funcționare, diferența e2 - u2 este mică, deoarece și pierderile Joule în secundarul transformatorului sunt mici. Se poate deci considera că practic, puterea P1 din primar și cea din secundar P2 sunt egale: P1 = P2 sau U1I1 = U2I2, de unde:
Pentru cazul transformatorului care funcționează în sarcină, în sensul că la bornele primarului se aplică tensiunea alternativă u1, iar la bornele înfășurării secundare este conectat un receptor (consumator), procesele fizice sunt, în principal, următoarele: circuitul secundar fiind închis printr-un consumator oarecare, rezistiv sau rezistiv-reactiv, t.e.m. e2 produce în el un curent de intensitate i2. Acest curent produce la rândul său un flux Φ2 care, conform legii lui Lenz, este de sens contrar fluxului creat de curentul primar, denumit flux de regim Φ1. Având în vedere faptul că transferul de putere din primar în secundar (realizat prin cuplaj magnetic) face să apară o serie de pierderi de natură electrică și magnetică (prin efect Joule în înfășurări și pierderi prin curenți turbionari și histerezis în miezul de fier) valoarea maximă a fluxului Φ2 este mai mică decât valoarea maximă a lui Φ1. Diferența celor două fluxuri constituie fluxul principal prin transformator și este practic egal cu fluxul Φ = Φm cos ωt produs de curentul primar la mersul în gol al transformatorului: Φ = Φ1 - Φ2 = Φm cos ωt. La o creștere a sarcinii, valoarea maximă a lui Φ2 crește și are ca efect tendința de scădere a fluxului principal Φ. Ca efect, din relația:
Așadar, când crește sarcina transformatorului, adică crește I2, crește și intensitatea curentului I1 prin circuitul primar, deoarece puterea furnizată în secundar crește și deci trebuie să crească și puterea absorbită de primar de la rețeaua de alimentare. Invers, la scăderea puterii în secundar, scade și puterea absorbită de primar.
Aplicații
Principala utilizare este la transportul energiei electrice pe distanțe mari, prin implementarea liniilor de înaltă tensiune (zeci sau sute de kilovolți). Aceasta este necesar din rațiuni economice. La capătul de aplicare (intrare) a energiei se folosesc transformatoare ridicătoare de tensiune, iar la destinație energia se transmite linilor de joasă tensiune prin intermediul unor transformatoare coborâtoare de tensiune electrică. Prin folosirea unor tensiuni înalte și foarte înalte se scade curentul prin linie la valori care reduc pierderile prin efect Joule la un nivel rezonabil, astfel nefiind necesară utilizarea unor conductoare cu secțiuni sensibil mai mari, care ar ridica costul construcției și conservării linilor electrice de transport de energie.
Funcția transformatorului
În circuitele și rețelele electrice, transformatorul realizează transfer de energie (electrică) dintr-un circuit (rețea) de anumiți parametri - tensiune U, curent I, rezistență R - , în energie electrică cu alți parametri (valori) de circuit, în condițiile unei separări (izolări) galvanice între cele două circuite (rețele) electrice. Practic se acceptă, că energia electrică obținută la ieșire, în circuitul (circuitele, dacă sunt mai multe) secundar este aproximativ egală cu cea de la intrare, din circuitul primar. Totuși în calcule de proiectare pierderile de energie (din transformator) sunt luate în considerație.
Principiul de funcționare
Presupunem că ambele circuite ale transformatorului au spirele înfășurate în același sens și că au N1 respectiv N2 spire[1]. Transformatorul se consideră că funcționează în gol (i2=0, adică circuitul secundar este deschis). Dacă se aplică transformatorului tensiunea alternativă u1 de valoare efectivă U1 în primar apare curentul de intensitate i1 și valoare efectivă I1. Acesta, conform legii Biot-Savart, dă naștere unui flux magnetic alternativ având valoarea instantanee Φ = Φmcos ωt. Acest flux variabil care străbate spirele ambelor înfășurări face să apară în cele N1 spire ale primarului o t.e.m. de autoinducție:
- u1 + e1 = R1 i1
- e1 ≈ -u1
- e2 = -u2
Dacă la bornele transformatorului se conectează un consumator rezistiv de rezistență RS, prin circuitul secundar va apărea curentul de intensitate i2. În acest caz, u2 ≈ e2 deoarece apare căderea de tensiune pe sarcină RS i2. În condiții normale (nominale) de funcționare, diferența e2 - u2 este mică, deoarece și pierderile Joule în secundarul transformatorului sunt mici. Se poate deci considera că practic, puterea P1 din primar și cea din secundar P2 sunt egale: P1 = P2 sau U1I1 = U2I2, de unde:
Pentru cazul transformatorului care funcționează în sarcină, în sensul că la bornele primarului se aplică tensiunea alternativă u1, iar la bornele înfășurării secundare este conectat un receptor (consumator), procesele fizice sunt, în principal, următoarele: circuitul secundar fiind închis printr-un consumator oarecare, rezistiv sau rezistiv-reactiv, t.e.m. e2 produce în el un curent de intensitate i2. Acest curent produce la rândul său un flux Φ2 care, conform legii lui Lenz, este de sens contrar fluxului creat de curentul primar, denumit flux de regim Φ1. Având în vedere faptul că transferul de putere din primar în secundar (realizat prin cuplaj magnetic) face să apară o serie de pierderi de natură electrică și magnetică (prin efect Joule în înfășurări și pierderi prin curenți turbionari și histerezis în miezul de fier) valoarea maximă a fluxului Φ2 este mai mică decât valoarea maximă a lui Φ1. Diferența celor două fluxuri constituie fluxul principal prin transformator și este practic egal cu fluxul Φ = Φm cos ωt produs de curentul primar la mersul în gol al transformatorului: Φ = Φ1 - Φ2 = Φm cos ωt. La o creștere a sarcinii, valoarea maximă a lui Φ2 crește și are ca efect tendința de scădere a fluxului principal Φ. Ca efect, din relația:
Așadar, când crește sarcina transformatorului, adică crește I2, crește și intensitatea curentului I1 prin circuitul primar, deoarece puterea furnizată în secundar crește și deci trebuie să crească și puterea absorbită de primar de la rețeaua de alimentare. Invers, la scăderea puterii în secundar, scade și puterea absorbită de primar.
Aplicații
Principala utilizare este la transportul energiei electrice pe distanțe mari, prin implementarea liniilor de înaltă tensiune (zeci sau sute de kilovolți). Aceasta este necesar din rațiuni economice. La capătul de aplicare (intrare) a energiei se folosesc transformatoare ridicătoare de tensiune, iar la destinație energia se transmite linilor de joasă tensiune prin intermediul unor transformatoare coborâtoare de tensiune electrică. Prin folosirea unor tensiuni înalte și foarte înalte se scade curentul prin linie la valori care reduc pierderile prin efect Joule la un nivel rezonabil, astfel nefiind necesară utilizarea unor conductoare cu secțiuni sensibil mai mari, care ar ridica costul construcției și conservării linilor electrice de transport de energie.
Legile Gazelor
Starea de agragare in care se gaseste o substanta este dependenta de presiune, de volum si de temperatura. Aceste marimi se numesc variabile de stare, intrucat folosesc la descrierea starii unei substante sau a unui amestec.
La o anumita cantitate de substanta, variabilele de stare sunt dependente intre ele. De exemplu, cand se incalzeste un corp, el se dilata, adica volumul este o functie de temperatura; daca se mareste volumul unui gaz la temperatura constanta, inseamna ca presiunea se micsoreaza, deci este dependenta de volum. Relatia matematica a variabile-
lor de stare reprezinta ecuatia termica de stare a substantei respective. Astfel, daca se noteaza presiunea cu p, volumul cu V si temperatura absoluta cu T, atunci intre aceste marimi exista relatia functionala:
f(p, V, T)=0
de unde, de exemplu, presiunea se poate exprima ca functie de volum si temperatura, adica p=f(V,T).
La gaze, fortele de atractie reciproca intre particule sunt slabe. Din acest punct de vedere se face o deosebire intre gaze perfecte sau ideale si gaze reale.
Gaze perfecte(ideale)
Prin gaze pefecte(ideale) se inteleg gazele la care fortele de atractie reciproca intre particule pot fi considerate nule.
Pentru a cerceta ecuatia termica de stare a gazelor perfecte se va considera constanta cate una din variabilele de stare si se va studia dependenta intre celelalte doua. Legile deduse astfel vor fi cuprinse apoi intr-o lege generala.
Legea lui Boyle-Mariotte
Legea lui Boyle- Mariotte arata ca : la temperatura constanta, volumul unei mase determinate de gaz este invers proportional cu presiunea sub care se afla gazul.
De exemplu, daca se dubleaza presiunea exercitata asupra a 2l gaz, volumul gazului descreste pana la 1 l. Matematic legea se scrie:
V1/ V2 = p2/ p1 ,
sau
p1 V1= p2 V2 ,
in care V1 si p1 reprezinta volumul si presiunea initiala a gazului, iar V2 si p2, noul volum si noua presiune.
Deci, la temperatura constanta, produsul dintre presiunea si volumul unei mase anumite de gaz este constant:
pV=k; k=const.
k este o constanta valabila pentru o anumita temperatura( si anumita cantitate de gaz). Reprezentand grafic dependenta presiunii p de volumul V se obtine pentru fiecare tempe-ratura o hiperbola echilaterala. Asemenea curbe se numesc izoterme(in lb. greaca: isos= egal, thermos= cald).
Legea lui Boyle-Mariotte are valabilitate in domeniul presiunilor nu prea mari si la temperaturi normale. La presiuni foarte inalte, toate gazele prezinta abateri de la aceas-
ta lege.Astfel, de exemplu, daca la azot la presiunea de 1 At, produsul pV=1, la 1000 At, pV>2, ceea ce dovedeste o abatere de la comportarea de gaz perfect.
Legea lui Gay-Lussac
Variatia volumului unui gaz cu temperatura la presiune constanta este exprima-ta prin legea lui Gay-Lussac: la presiune constanta, volumul unei mase determinate de gaz se mareste(sau se micsoreaza), pentru fiecare crestere(sau scadere) de 1 C, cu 1/273 din volumul pe care il ocupa la 0 C).
Valoarea 1/273, mai exact 1/273,15, se numeste coeficientul de dilatare termica a gazelor ideale.
Notand cu V0 volumul gazului la 0 C, iar cu V1 volumul pe care il ocupa la temperatura t1, legea se poate scrie:
V1= V0+V0/273t1=V0(273+t1/273).
Adoptand notarea temperaturilor in grade Kelvin: T=273+t, legea lui Gay-Lussac poate fi exprimata intr-o forma mai adecvata:
V1= V0*T1/273.
Deoarece V0/273 are o valoare constanta pentru gazul respectiv, inseamna ca la o temperatura T2, volumul aceluiasi gaz va fi:
V1= V0 *T2/273.
Asadar:
V1/V2=T1/T2 sau V1/T1= V2/T2.
Deci, la presiune constanta, volumul unei mase determinate de gaz variaza direct proportional cu temperatura absoluta:
V/T=k’; k’=const;
Reprezentarea grafica a relatiei intre volumul gazului si temperatura la presiu-ne constanta este o dreapta care intersecteaza ordonata intr-un punct ce corespunde valo-rii V0. O asemenea dreapta se numeste izobara(in lb. greaca barys=greu).
Pentru mase diferite de gaze rezulta o familie de drepte care intersecteaza ordonata in puncte diferite si se intalnesc intr-un punct pe abscisa, corespunzator la
t=-273 C
In mod analog, legea lui Gay-Lussac arata ca: la volum constant, presiunea unui gaz creste(sau scade) pentru fiecare crestere(sau scadere) de 1 C, cu 1/273 din presiunea pe care o are gazul la 0 C.
Asa, de exemplu, un gaz cu volumul de 273 ml la 0 C are volumul 273 ml la
1 C(si aceeasi presiune), de 275 ml la 2 C, de 373 ml la 100 C etc.
Daca se noteaza cu p0 presiunea gazului la 0 C, iar cu p1 presiunea gazului la temperatura t1, aceasta lege se poate scrie:
p1=p0+p0/273* t1=p0((273+t1)/273).
Rationand in modul aratat mai sus, se ajunge la relatia:
p1/ p2= T1/ T2 sau p1/ T1= p2/T2.
Deci, la volum constant, presiunea unei mase determinate de gaz variaza direct proportional cu temperatura absoluta:
P/T=k’’; k’’=const.
Reprezentarea grafica a relatiei dintre presiunea gazului si temperatura la volum constant este o dreapta care intersecteaza ordonata intr-un punct ce corespunde valorii p0. O asemenea dreapta se numeste izocora(in lb. greaca: core=spatiu).
Pentru mase diferite de gaze p0 are valori diferite, iar izocorele sunt drepte care se intalnesc intr-un punct pe abscisa, corespunzand la t=-273 C.
Legea lui Avogadro
Cand se combina un volum de hidrogen cu un volum de clor rezulta doua volume de acid clorhidric; tot asa, cand se combina doua volume de hidrogen cu un volum de oxigen se obtin doua volume doua volume de apa(vapori); prin combinarea a trei volume de hidrogen cu un volum de azot se obtin doua volume de amoniac gazos. Se constata ca volumele gazelor care se combina se gasesc intre ele in raporturi de numere intregi si mici 1:1; 2:1; 3:1.
Tot asa si intre volumul compusilor rezultati si volumul fiecareia dintre compo-
nente exista de asemenea un raport simplu 2:1; 2:2; 2:3, respectiv 2:1; 2:1; 2:1.
Studiind raporturile de combinare a volumelor in timpul reactiilor chimice, intre gaze, Gay-Lussac a stabilit(1808) ca: volumele a doua gaze care se combina se afla intre ele, cum si fata se volumul combinatiei rezultate din reactie, intr-un raport de numere intregi si mici(legea volumelor constante).
Comportarea gazelor la variatii de presiune si temperatura cum isi raportul de volume simple rezultate din reactiile lor chimice a condus pe A.Avogadro sa enunte(in 1811) ipoteza devenita ulterior lege: volume egale de gaze diferite, in aceleasi conditii de temperatura si presiune, contin acelasi numar de molecule. Aceasta lege arata ca, daca, de exemplu, la o anumita temperatura si presiune, un volum de hidrogen contine A molecule de hidrogen, un acelasi volum de clor, la aceeasi temperatura si presiune, contine tot A molecule de clor.
Cand se combina un volum de hidrogen cu un volum egal de clor, inseamna ca toate moleculele din volumul de hidrogen se combina cu toate moleculele din volumul de clor si rezulta 2 A molecule de acid clorhidric.
Dupa legea lui Avogadro, la numere egale de molecule, volumele substantelor gazoase corespunzatoare trebuie sa fie egale, si deoarece la A molecule corespunde un volum, la 2A molecule trebuie sa corespunda doua volume. Asa se explica de ce acidul clorhidric ocupa doua volume.
Cand se combina doua volume de hidrogen cu un volum de oxigen reactia decurge intre 2Amolecule de hidrogen si A molecule de oxigen. Gazele avand moleculele formate din doi atomi, in reactie 4A atomi de hidrogen se combina cu 2A atomi de oxi-
gen. Deoarece o molecula de apa contine doi atomi de hidrogen si un atom de oxigen, din reactie rezulta 2A de molecule de apa.
In mod similar, cand se combina trei volume de hidrogen cu un volum de azot, se combina 3A molecule de hidrogen cu A molecule de azot. Aceasta inseamna ca reactia are loc intre 6A atomi de hidrogen si 2A atomi de azot. Deaoarece o molecula de amoniac este formata din trei atomi de hidrogen si un atom de azot, din reactie rezulta 2A molecule de amoniac, carora le corespund doua volume.
Prin urmare, cu ajutorul legii lui Avogadro, tinand seama de raportul de combinare, legea volumelor constante este verificata in intregime.
Determinarea numarului de atomi dintr-o molecula de gaz.
Din legea lui Avogadro rezulta o consecinta foarte importanta, si anume ca moleculele celor mai cunoscute gaze elementare, ca de exemplu hidrogenul, oxigenul, clorul sunt biatomice. Rationamentul este urmatorul: daca un volum de hidrogen reactio-
neaza cu un volum de clor pentru a forma doua volume de acid clorhidric, inseamna ca fiecare molecula a compusului trebuie sa contina cel putin un atom de hidrogen si un atom de clor. Fiindca doua volume de acid clorhidric sunt obtinute din un volum de hidrogen si un volum de clor concluzia este ca fiecare molecula de hidrogen sau de clor contine doi atomi.
Volum molar. Cu ajutorul legii lui Avogadro se poate determina volumul unei molecule-gram de gaz.. Daca volume egale de gaze diferite, luate in aceleasi conditii de temperatura si presiune, contin acelasi numar de molecule, ocupa volume egale.
Tinand seama ca o molecula-gram a unei substante(un mol) reprezinta cantitatea dintr-o substanta a carei masa, exprimata in grame, este numeric egala cu masa ei mole-culara, inseamna ca in molecula-gram a diferitelor substante exista acelasi numar de molecule. Astfel, un mol de orice de gaz contine 23
6,025*10 molecule. Acest numar se numeste numarul lui Avogadro si se noteaza cu N. El reprezinta totodata si numarul de atomi cuprinsi intr-un atom-gram.
Deoarece, dupa Avogadro, acelasi numar de molecule intr-un gram de gaz in conditii egale ocupa acelasi volum, inseamna ca o molecula-gram de gaz, care contine
23
6,025*10 molecule, ocupa acelasi volum, independent de natura gazului.
Volumul ocupat de o molecula-gram din orice gaz(la 0 C si 760 mm Hg) este de 22,414 l. El se numeste volum molar sau volum molecular.
Volumul molar a fost calculat din raportul dintre molecula-gram si densitatea gazelor.Cunoscand volumul molar al gazelor se pot rezolva problemele care se refera la relatia intre volumul si masa gazelor.
Ecuatia de stare a gazelor perfecte
Legea lui Boyle-Mariotte pV=k, si legea lui Gay-Lussac: V/T=k’, pot fi reunite intr-o singura expresie. Pentru aceasta se considera ca gazul respectiv are initial presiunea
p0=1 At, T0=273 K si volumul V0.(Aceste conditii se numesc normale).
Daca, mentinand presiunea constanta, gazul se incalzeste la temperatura T, volu-
mul va creste de la V0 la Vt :
Vt= V0/ T0*T. (1)
Daca mentinand acum temperatura constanta, se mareste presiunea gazului de la p0 la p, volumul va creste de la Vt la V:
p0 Vt=pV (2)
Introducand valoarea lui Vt din relatia (1), rezulta:
p0V0/T0=pV/T (3)
Deoarece in partea stanga a relatiei sunt numai marimi constante, inseamna ca si partea dreapta trebuie sa fie constanta, adica:
pV/T=k. (4)
Daca se aplica relatia (4) la un mol al unui gaz, care, conform legii lui Avogadro, are un volum constant V, rezulta ca :
pV/T=R (5)
Constanta R este independenta de natura gazului; ea se numeste constanta gazelor perfecte( sau mai simplu, constanta gazelor). Expresia:
pV=RT
se numeste ecuatia de stare a gazelor perfecte.
Daca n molecule-gram de gaz ocupa volumul V, atunci 1 mol va ocupa volumul
V/n . Ecuatia de stare a gazelor perfecte devine atunci:
p*V/n=RT,
sau
pV= nRT. (6)
Numarul n de molecule-gram este insa egal cu raportul dintre masa m a gazului, exprimata in grame, si valoarea mesei lui moleculare, M, adica:
n=m/M
Inlocuind aceasta relatie in formula de mai sus, se obtine expresia:
pV=m/M*RT.
Fluxul magnetic
B=inductia magneticaF=BIL B=F/IL
Def. Inductia magnetica este marimea fizica vectoriala definita prin forta cu care campul magnetic acctioneaza asupra unui conductor cu lungimea de 1 m aflat in camp magnetic si prin care trece un curent de 1 Amper
Este o marime fizica care caracterizeaza campul magnetic din punct de vedere al intensitatii interactiuni magnetice
=1 Tesla(T)
Pentru a face o legatura intre inductia magnetica si suprafata strabatuta sa introdus o noua marime fizica scalara numita fluxul magnetic
Fluxul magnetic este marimea fizica numeric egala cu produsul dintre inductia magnetica si suprafata normala strabatuta
Sn se obtine prin inmultirea suprafetei S cu versrul n care este un vector cu valoarea numerica l si cu diresctia perpendiculara pe suprafata.
Formula de definitie 0=BxSn este valabila in cazul in care suprafata este perpendiculara pe liniile de camp. In caz contrar se foloseste formula 0=BxScos alfa
alfa este unghiul dintre liniile de camp si versor n
Inductia electromagnetica
Inductia electromagnetica este marmea fizica vectoriala iar inductia electromagnetica este un fenomen fizic.
fenomenuyl de producere a unei tensiuni electromotoare datorita variatiei fluxului magnetic se numeste inductie electromagnetica
Legea inductiei electromagnetica: tensiunea electomotoare indusa de prorprtionala cu viteza de variatie a fluxului magnetic cu semn schimbat
autoinductia
In prima expeirenta curentul electric prin circuit creste de la 0 la valoarea maxima intr-un timp relativ mai mare.
Cauza cresterii curentului electric produce in bobina o variatie a inductiei magnetice si a fluxului magnetic
In acest caz prin circuit se induce o tensiune electromotoare care produca un curent electric indusa a carui sens este opus din circuit. Curentul total va fi mai mic. Deacea ampermetru indica o crestere lenta a curentului
In a 2 experienta scaderea fluxului magnetic produce un curent electric cu acelasi sens care suprapunanduse pe cel initial produce sclipirea becului
Autoinductia este fenomenul de producere aunui curent electric printr-un circuit datorita variatiei curentului prin acel circuit.
Legea autoinductiei: tensiunea electromotoare auto indusa este proportionala cu viteza de variatie a curentului electric cu semn schimbat
Curentul electric trifazat
Este acel curent prin care se obtin 3 faze in timpul unei relatii complete a rotorului in stator. Se obtine folosind pe 3 bobine asezate sub un unghi de 120 grade.
Tensiunea dintree doua faze care este de 380V iar intre faza si nul 220V
Trensformatorul
Transformatorul este un dispozitiv folosit pentru a modifica tensiunea in 2 circuite electrice.
Transformatorul este format dintr-un miez metalic (fier si siliciu) sub forma de tole(placute)
Pe cadrul respectiv sunt fixate 2 bobinecare se fixeaza la circuitul cu sursa electrica se numeste bobina primara(circuit primar ) iar cealalta bobina secundara(circuit secundar)
Transformatorul se foloseste in curent alternativ. El poate fi folosit pentru ridicarea tensiunii(transformator ridicator de tensiune) sau pentru a cobora tensiunea (transformator pentru coborarea tensiunii)
Functionarea transformatorului la trecerea curentului electric alternativ prin bobina primara in aceasta apare un camp macnetic variabil acest camp macnetic variabil se inchide prin miezul de fier si produce prin bobina secundara a tensiunii electromotoare indusa a carui valoare depinde (este proportionala cu numarul spirelor bobinei)
Gazul ideal
Gazul ideal este un model de studiu in termodinamica
Conditii pentru ca un gaz sa fie considerat gaz ideal:
a) gazul trebuie sa contina un numar foarte mare de particole identice
b) particolele sa efectueze o miscare dezordonata dar care sa respecte legile mecanicii clasice
c) distanta dintre particole sa fie mult mai mare decat dimensiunile lor
d) intre particole sa nu se exercite forte de interactiune
e) ciocnirile dintre particole si pereti vasului sa fie perfect clasice
Gazul real poate fi considerat gaz ideal daca presiunea lui este scazuta
Ecuatia de stare a gidealazului
Intre parametri care caracterizeaza starea termodinamica la un moment dat exista o relatie(ecuatie) de legatura care se numeste ecuatia de stare a gazului ideal
Legea transformarii izoterme este acea transformare in care temperatura ramane constanta
Intro transformare izoterma volumul variaza invers proportonal ci presiunea
Temperatura. Scari de temperatura
Temperatura este marimea fizica de stare care caracterizeaza starea de incalzire a unui corp
Avem un contact termic atunci cand doua corpuri puse in contact fac schimb de caldura intre ele. corpul mai cald se raceste iar cel rece se incalzeste
Doua corpuri in echilibru termic au aceasi temperatura
Scari de temperatura
Instrumentul pentru masurat temperatura se numeste termometru. Pentru ca sa putem masura temperatura trebuie sa gasim un corp termometric care sa posede o propritate care variaza cu temperatura.
Corpurile termometrice pot fi:lichide (mercur,alcool), gazoase (hidrogenul, heliu, argom), solide (concucatoare metalice)
Cea mai importanta proprietate care variaza cu temperatura este volumul corpurilor
Pentru a putea masura temperatura trebuie sa avem o relatie care sa arate dependenta volumului cu temperatura de asemenea trebuie sa stabilim o scara de temperatura care contine aceasta dependenta si doua puncte termice usor reproductibile. Punctele cele mai usor reproductibile sunt:
-punctul de topire al ghetei
-punctul de fierdere al apei
Scara de temperatura ceslsius are punctul triplu al apei la 0* si punctul de fierbere al apei la 100*C
Pentru a etalona un termometru in scara celsius se introduce termometru in apa ci gheata la pozitia din termometru se noteaza 0* dupa care termometru se introduce intr-un vas in care fierbe apa si se noteaza 100*C
Portiunea intre cele doua diviziuni se imparete la 100 si se obtine un drad.
Def. Inductia magnetica este marimea fizica vectoriala definita prin forta cu care campul magnetic acctioneaza asupra unui conductor cu lungimea de 1 m aflat in camp magnetic si prin care trece un curent de 1 Amper
Este o marime fizica care caracterizeaza campul magnetic din punct de vedere al intensitatii interactiuni magnetice
=1 Tesla(T)
Pentru a face o legatura intre inductia magnetica si suprafata strabatuta sa introdus o noua marime fizica scalara numita fluxul magnetic
Fluxul magnetic este marimea fizica numeric egala cu produsul dintre inductia magnetica si suprafata normala strabatuta
Sn se obtine prin inmultirea suprafetei S cu versrul n care este un vector cu valoarea numerica l si cu diresctia perpendiculara pe suprafata.
Formula de definitie 0=BxSn este valabila in cazul in care suprafata este perpendiculara pe liniile de camp. In caz contrar se foloseste formula 0=BxScos alfa
alfa este unghiul dintre liniile de camp si versor n
Inductia electromagnetica
Inductia electromagnetica este marmea fizica vectoriala iar inductia electromagnetica este un fenomen fizic.
fenomenuyl de producere a unei tensiuni electromotoare datorita variatiei fluxului magnetic se numeste inductie electromagnetica
Legea inductiei electromagnetica: tensiunea electomotoare indusa de prorprtionala cu viteza de variatie a fluxului magnetic cu semn schimbat
autoinductia
In prima expeirenta curentul electric prin circuit creste de la 0 la valoarea maxima intr-un timp relativ mai mare.
Cauza cresterii curentului electric produce in bobina o variatie a inductiei magnetice si a fluxului magnetic
In acest caz prin circuit se induce o tensiune electromotoare care produca un curent electric indusa a carui sens este opus din circuit. Curentul total va fi mai mic. Deacea ampermetru indica o crestere lenta a curentului
In a 2 experienta scaderea fluxului magnetic produce un curent electric cu acelasi sens care suprapunanduse pe cel initial produce sclipirea becului
Autoinductia este fenomenul de producere aunui curent electric printr-un circuit datorita variatiei curentului prin acel circuit.
Legea autoinductiei: tensiunea electromotoare auto indusa este proportionala cu viteza de variatie a curentului electric cu semn schimbat
Curentul electric trifazat
Este acel curent prin care se obtin 3 faze in timpul unei relatii complete a rotorului in stator. Se obtine folosind pe 3 bobine asezate sub un unghi de 120 grade.
Tensiunea dintree doua faze care este de 380V iar intre faza si nul 220V
Trensformatorul
Transformatorul este un dispozitiv folosit pentru a modifica tensiunea in 2 circuite electrice.
Transformatorul este format dintr-un miez metalic (fier si siliciu) sub forma de tole(placute)
Pe cadrul respectiv sunt fixate 2 bobinecare se fixeaza la circuitul cu sursa electrica se numeste bobina primara(circuit primar ) iar cealalta bobina secundara(circuit secundar)
Transformatorul se foloseste in curent alternativ. El poate fi folosit pentru ridicarea tensiunii(transformator ridicator de tensiune) sau pentru a cobora tensiunea (transformator pentru coborarea tensiunii)
Functionarea transformatorului la trecerea curentului electric alternativ prin bobina primara in aceasta apare un camp macnetic variabil acest camp macnetic variabil se inchide prin miezul de fier si produce prin bobina secundara a tensiunii electromotoare indusa a carui valoare depinde (este proportionala cu numarul spirelor bobinei)
Gazul ideal
Gazul ideal este un model de studiu in termodinamica
Conditii pentru ca un gaz sa fie considerat gaz ideal:
a) gazul trebuie sa contina un numar foarte mare de particole identice
b) particolele sa efectueze o miscare dezordonata dar care sa respecte legile mecanicii clasice
c) distanta dintre particole sa fie mult mai mare decat dimensiunile lor
d) intre particole sa nu se exercite forte de interactiune
e) ciocnirile dintre particole si pereti vasului sa fie perfect clasice
Gazul real poate fi considerat gaz ideal daca presiunea lui este scazuta
Ecuatia de stare a gidealazului
Intre parametri care caracterizeaza starea termodinamica la un moment dat exista o relatie(ecuatie) de legatura care se numeste ecuatia de stare a gazului ideal
Legea transformarii izoterme este acea transformare in care temperatura ramane constanta
Intro transformare izoterma volumul variaza invers proportonal ci presiunea
Temperatura. Scari de temperatura
Temperatura este marimea fizica de stare care caracterizeaza starea de incalzire a unui corp
Avem un contact termic atunci cand doua corpuri puse in contact fac schimb de caldura intre ele. corpul mai cald se raceste iar cel rece se incalzeste
Doua corpuri in echilibru termic au aceasi temperatura
Scari de temperatura
Instrumentul pentru masurat temperatura se numeste termometru. Pentru ca sa putem masura temperatura trebuie sa gasim un corp termometric care sa posede o propritate care variaza cu temperatura.
Corpurile termometrice pot fi:lichide (mercur,alcool), gazoase (hidrogenul, heliu, argom), solide (concucatoare metalice)
Cea mai importanta proprietate care variaza cu temperatura este volumul corpurilor
Pentru a putea masura temperatura trebuie sa avem o relatie care sa arate dependenta volumului cu temperatura de asemenea trebuie sa stabilim o scara de temperatura care contine aceasta dependenta si doua puncte termice usor reproductibile. Punctele cele mai usor reproductibile sunt:
-punctul de topire al ghetei
-punctul de fierdere al apei
Scara de temperatura ceslsius are punctul triplu al apei la 0* si punctul de fierbere al apei la 100*C
Pentru a etalona un termometru in scara celsius se introduce termometru in apa ci gheata la pozitia din termometru se noteaza 0* dupa care termometru se introduce intr-un vas in care fierbe apa si se noteaza 100*C
Portiunea intre cele doua diviziuni se imparete la 100 si se obtine un drad.
marți, 11 ianuarie 2011
Fizica este o ştiinţă a naturii care studiază structura materiei, proprietăţile generale, legile de mişcare, formele de existenţă a materiei, precum şi transformările reciproce ale acestor forme.
- chimia se ocupă de interacţiunea atomilor de a forma molecule;
- geografia modernă studiază fizica pământului (geofizica);
- astronomia are legătură cu fizica stelelor şi a spaţiului interstelar;
- biofizica şi biochimia studiază aceleaşi tipuri de legi.
Idei despre lumea fizicii datează din antichitate, dar, ca obiect de studiu, fizica a apărut la sfârşitul secolului al XIX-lea.
În antichitate, babilonienii şi egiptenii au observat mişcările planetelor, au prezis eclipsele, dar nu au reuşit să găsească legile care guvernează mişcările planetelor.
Civilizaţia greacă a adăugat foarte puţin la descoperirile anterioare, pentru că au admis, fără a critica, ideile celor doi filosofi Platon şi Aristotel, care nu acceptau experimentele practice.
La Alexandria, Arhimede a făcut numeroase mecanisme practice. A inventat mecanismul pârghiei şi cel al înşurubării, a descoperit principiul măsurării densităţii corpurilor solide prin scufundarea lor în lichide.
Astronomul grec Aristarchus din Samos a măsurat proporţia distanţelor de la Pământ la Soare şide la Pământ la Lună.
În perioada Evului Mediu, s-a încercat avansarea cercetărilor în ştiinţele naturii, dar nu s-a reuşit.
În timpul Renaşterii, s-au făcut încercări pentru a interpreta comportamentul stelelor.
Filosoful Nicolaus Copernicus a susţinut că planetele se mişcă în jurul Soarelui – sistemul heliocentric. El era convins că orbitele planetelor sunt circulare.
Astronomul german Johannes Kepler a confirmat teoria heliocentrică.
Galileo Galilei şi-a construit un telescop şi începând cu 1609, a confirmat sistemul heliocentric, prin observarea planetei Venus. El a descoperit suprafaţa neregulată a Lunii, primii patru sateliţi luminoşi ai lui Jupiter, pete pe Soare, multe stele din Calea Lactee.
Principalele ramuri ale fizicii sunt: mecanica, electricitatea şi magnetismul, termodinamica, fizica atomică şi moleculară, mecanica cuantică, fizica nucleară.
Mecanica
Legile lui Newton au dus la dezvoltarea mecanicii. Newton a avut o contribuţie majoră în descrierea forţelor în natură, în special a forţelor gravitaţionale.
Fizicienii de astăzi ştiu că mai există trei forţe fundamentale, în afară de cea a gravitaţiei: forţele electromagnetice, forţele de interacţiune nucleară şi forţele radioactivităţii.
Forţele gravitaţionale guvernează mişcarea planetelor şi poate fi responsabilă de posibilul colaps gravitaţional, care este ultimul ciclu din viaţa unei stele.
Forţa gravitaţiei este cea mai slabă dintre cele patru forţe ale naturii referitoare la particulele elementare.
În ciuda importanţei macroscopice, forţa gravitaţională rămâne slabă şi de aceea, corpurile trebuie să fie foarte mari ca să fie simţite de alt corp.
Legea gravitaţiei universale a fost dedusă din observaţiile mişcărilor planetelor, înainte de a fi verificate experimental. Demonstraţia experimentală a fost făcută de Henry Cavendish în 1771.
Matematicianul elveţian Leonhard Euler a formulat, pentru prima oară, ecuaţia mişcării pentru corpurile rigide, în timp ce Newton a lucrat cu mase concentrate într-un punct, care acţionau ca particule.
Electricitate şi magnetism
Deşi grecii antici ştiau proprietăţile electrostatice ale chihlimbarului, iar chinezii au făcut magneţi încă din 2700 î.Chr., experimentarea şi înţelegerea electricităţii şi a fenomenelor magnetice nu s-au realizat până la sfârşitul secolului XVIII. În 1785, fizicianul francez Augustin de Coulomb a confirmat, experimental, că sarcinile electrice se atrag şi se resping, conform unei legi similare cu cea a gravitaţiei. O particulă încărcată cu sarcină pozitivă, atrage o particulă încărcată cu sarcină negativă şi au tendinţa de a accelera una spre cealaltă. În 1800, fizicianul italian Alessandro Volta a descoperit bateria chimică.
Fizicianul german Georg Simon Ohm a descoperit existenţa unei proporţionalităţi simple şi constante între curentul continuu şi puterea electromotoare dată de baterie, cunoscută drept rezistenţa circuitului.
Concepţia istorică de magnetism, bazată pe existenţa unei perechi de poli încărcaţi cu sarcini opuse, a apărut în secolul al XVII-lea, datorită muncii lui Augustin de Coulomb.
Prima conexiune între magnetism şi electricitate a apărut ca urmare a experimentelor făcute de fizicianul şi chimistul olandez Hans Christian Oersted, care, în 1819, a descoperit că acul magnetic poate fi influenţat de o sârmă din apropiere, încărcată cu sarcină electrică.
Andre Marie Amper a arătat, experimental, că două fire electrice se atrag ca doi poli magnetici.
În 1887, Heinrich Rudolf Hertz, fizician german, a avut succes în generarea unor unde electromagnetice care se propagau în spaţiu cu viteza luminii. Aceste unde au fost produse cu ajutorul curentului electric. Astfel, s-au pus bazele radioului, radarului, televiziunii şi a altor forme de telecomunicaţie.
Propagarea lineară a luminii era cunoscută din antichitate. Grecii antici credeau că lumina este corpusculară. În secolul XVII, Isaac Newton a dat o teorie bazată pe proprietatea corpusculară a luminii. Robert Hooke – fizician şi Christiaan Huygens – astronom, matematician şi fizician, au propus o teorie de undă, dar nu s-a putut face nici un experiment pentru a demonstra oricare dintre cele două teorii, până la demonstraţia de interfaţă a luminii, realizată de Thomas Young, în prima parte a secolului XIX. O altă demonstraţie a fost făcută de fizicianul francez Fresnel, în favoarea teoriei de undă.
Termodinamica
A început să fie demonstrată de fizicieni în secolul XIX:
- William Thomson (legea I a termodinamicii);
- Nicolas Leonard Sadi Carnot (legea a II-a a termodinamicii, 1824);
- Joseph Louis Gay-Lussac şi Jacques Alexandre Cezar-Charles (transformarea izobară, izocoră şi izotermă şi adiabată).
Teoria cinetică
Conceptul modern al atomului a fost propus de chimistul şi fizicianul britanic John Dalton în 1808.
În 1880, cele mai multe fenomene puteau fi explicate de mecanica newtoniană, teoria electromagnetică a lui Maxwel, termodinamică şi statistica mecanică a lui Boltzmann.
Probleme precum determinarea proprietăţilor eterului şi explicaţia spectrului de radiaţii din solide şi gaze erau necunoscute. Aceste fenomene au pus baza unei revoluţii ştiinţifice. Au fost făcute o serie de descoperiri remarcabile ale ultimului deceniu al secolului al XIX-lea: descoperirea razelor X de către W. C. Roentgen în 1895; descoperirea electronului de către J. J. Thomson în 1895; a radioactivităţii de către A.H. Becquerel în 1896 şi a efectului fotoelectric de către Hertz, W. Hallwachs şi P.E. Alenard în perioada 1887-1889.
Toate aceste descoperiri au fost explicate în primii 30 de ani ai secolului XX prin teoria cuantică şi teoria relativităţii, punând bazele fizicii moderne.
Fizica modernă
Teoria relativităţii
În 1905, Albert Einstein a formulat teoria relativităţii. El a continuat şi definitivat experimentul făcut de Michelson-Morley.
În 1915, Einstein generalizează ipoteza sa şi formulează teoria generală a relativităţii, care se aplică tuturor sistemelor ce se accelerează unul faţă de celălalt.
Teoria cuantică
Spectrul emis de corpuri luminate a fost pentru prima dată explicat de fizicianul Max Planck.
Planck a făcut presupunerea că moleculele pot emite unde electromagnetice.
Fotoelectricitatea
Principalele aspecte ale fenomenului de fotoelectricitate sunt:
- rata emisiei de electroni depinde de intensitatea luminii şi nu de frecvenţă;
- fotoelectronii sunt emişi imediat ce lumina atinge suprafaţa de emisie.
Aceste observaţii nu au putut fi explicate prin teoria electromagnetică a lui Maxwell.
Einstein a presupus în 1905 că lumina poate fi absorbită numai în fotoni. Fotonul dispare complet în procesul de absorbţie, iar toată energia lui se duce la un electron din metal. Cu această presupunere, Einstein a extins teoria cuantică dată de Planck, dând o importanţă deosebită dualităţii undă-particulă a luminii. Pentru aceasta, în 1921, Einstein a primit Premiul Nobel în fizică.
Razele X
Au fost descoperite de Roentgen şi au fost prezentate, în 1912, ca radiaţii electromagnetice de lungime foarte scurtă, de către fizicianul Max Theodor Felix von Lane şi colaboratorii săi.
Mecanismul producerii razelor X s-a arătat a fi un efect cuantic. În 1914, fizicianul britanic Henry Gwin-Jeffreis Moseley a folosit spectrograma de raze X pentru a dovedi că numărul atomic al elementelor este acelaşi cu poziţia sa în tabelul periodic al elementelor.
Mecanica cuantică modernă
A fost cercetată şi demonmstrată pentru prima dată între anii 1923-1930: Louis Victor (1923), Clinton Joseph Davisson, Lester Halbert Germer şi George Paget Thomson (experimentele din 1927) precum şi Werner Heisenberg, Max Born, Ernst Pascual Jordan şi Erwin Schrödinger.
Dezvoltarea fizicii din 1930 până în prezent
Dezvoltarea fizicii s-a bazat pe descoperirile fundamentale realizate până în 1930 şi pe evoluţia ulterioară a tehnologiei.
Radiaţiile cosmice
Au fost descoperite în 1911 de Victor Franz Hess. Acestea au fost cercetate mai bine odată cu lansarea în spaţiu a unui satelit artificial în 1959.
Fizica nucleară
În 1931, fizicianul american Harold Clayton Urey descoperă izotopul de hidrogen şi fabrică apa grea.
Fizicianul englez Otto Robert Frisch a descoperit că unele nuclee de uraniu pot fi divizate în două, fenomen numit fisiune nucleară. În acelaşi timp, o energie enormă este eliberată, împreună cu o parte de neutroni. Aceste rezultate susţineau posibilitatea unei reacţii în lanţ, obţinută de Fermi şi colaboratorii săi în 1942, când a intrat în funcţiune primul reactor nuclear. Dezvotarea tehnologiei a fost foarte rapidă, astfel încât în 1945 a fost realizată bomba nucleară de către fizicianul american Robert-Oppenhelmer. În 1956, în Marea Britanie intră în funcţiune primul reactor nuclear pentru producerea energiei electrice.
Studiind energia stelelor, s-a dovedit că în interiorul acestora au loc o serie de reacţii nucleare, la temperaturi de milioane de grade. S-a observat, astfel, că patru nuclee de hidrogen se transformă într-un nucleu de heliu. Acest proces s-a numit fusiune nucleară. Aşa s-a creat bomba cu hidrogen, care s-a detonat, pentru prima oară, în 1952 şi s-a demonstrat a fi mai puternică decât bomba cu fisiune. Pentru realizarea temperaturii de fusiune, este necesară o bombă cu fisiune.
În 1993, la Universitatea Princeton s-a produs, într-un mediu controlat, reacţia de fusiune în scopul obţinerii energiei electrice.
Plasma
Plasma este orice substanţă (gaz, de obicei) ai cărei atomi au unul sau mai mulţi electroni pierduţi. Electronii detaşaţi rămân în volumul de gaz neionizat. Ionizarea poate avea loc dacă este introdusă energie în concentraţie mare.
Plasma este găsită, de exemplu, în surse de lumină umplute cu gaz (neoane) şi în spaţiul interstelar, unde hidrogenul este ionizat de radiaţii.
Lasere
Laserul, o descoperire recentă şi importantă, este prescurtarea de la “Light Amplification by Stimulated Emission of Radiations”.
Laserul poate conţine gaze, lichide şi solide drept substanţă lucrătoare.
Un număr mare de atomi este ridicat la un nivel de energie foarte mare şi sunt forţaţi să elibereze această energie simultan, producând o lumină continuă. O tehnică similară este folosită în producerea microundelor.
Utilizarea laserului a fost dezvoltată în perioada 1950-1960 de către americanii Gordon-Gould şi Charles Hard Townes ş.a.
Laserul este astăzi foarte folosit în cercetare, comunicaţii, medicină, navigaţie, metalurgie, fusiune şi tăierea precisă a metalelor.
Abonați-vă la:
Comentarii (Atom)